Aceites esenciales.
Son
terpenos pero también pueden ser anillos bencénicos.
Características:
Son
insolubles en agua pero son arrastrables por el agua.
Son
compuestos volátiles.
Son
solubles en solventes poco polares y en alcoholes.
Los
aceites esenciales son los responsables de los aromas y sabores. Son
sustancias líquidas a temperatura ambiente.
Son
mezclas de sustancias. Hay pocos aceites esenciales donde hay 1 o 2
sustancias en su composición química, en general son mezclas de
muchas sustancias.
Muchos
de estos compuestos son terpenos: monoterpenos, sesquiterpenos y en
algunos casos biterpenos. También hay anillos bencénicos.
Método
de extracción: por destilación por arrastre de vapor de
agua.
Los
aceites esenciales están distribuidos en casi toda la planta y
pueden encontrarse en distintos órganos. Puede diferir la
composición química en la misma planta: el aceite esencial que se
encuentra en la hoja no necesariamente es el mismo que se encuentra
en las flores.
Lípidos.
Definición:
Serie de productos naturales que tienen la propiedad de ser
insolubles en agua y ser solubles en solventes poco polares (son
compuestos hidrofóbicos).
Extracción.
En
semillas: presentes entre 20-50%.
Por
expresión en frío o en caliente (prensas hidráulicas)
Extracción
por solventes no polares: éter de petróleo, hexano, tolueno,
ciclohexano, benceno (soxhlet). Pueden ser extraídos con cloroformo
pero es más eficiente utilizar solventes menos polares.
Lanolina:
detergentes en solución acuosa.
Comprenden
sustancias de distinta naturaleza química:
Triglicéridos:
aceites (líquidos) y grasas (sólidas) son mezclas de triglicéridos
de ácidos grasos que difieren en su estado físico y en su
estructura química (los aceites poseen alta proporción de ácidos
grasos insaturados y las grasas de ácidos grasos saturados)
Ácidos
grasos libres: son ácidos de
alto peso molecular en forma libre (por ejemplo: ácido esteárico).
Ceras:
son mezclas de ésteres de alcoholes de alto peso molecular (por
ejemplo: ésteres de dodecanol, ésteres de eicosanol) con ácidos
grasos diversos.
Esteroles:
son derivados del ciclopentanoperhidrofenantreno, en su forma libre
(β-sitoesterol),
como ésteres (palmitatos, estearatos) o glucósidos.
Carotenoides:
son tetraterpenoides (C40), generalmente acíclicos.
Fosfolípidos:
son triglicéridos que contiene grupos fosfato (por ejemplo:
lecitina)
Glucolípidos:
son triglicéridos que están unidos a restos azucarados.
Saponificación.
Las
uniones ésteres se pueden hidrolizar en medio alcalino (KOH)
formándose las sales del ácido graso (jabones) que son solubles en
soluciones acuosas.
Las
ceras saponifican si se realiza la reacción en potasa alcohólica
(KOH en etanol).
La saponificación es una reacción irreversible.
Fracción
saponificable:
se saponifican los triglicéridos, los céridos, los fosfolípidos y
los glucolípidos.
Fracción
insaponificable:
no se saponifican ni los esteroles ni los carotenoides.
Caracterización.
Mancha
aceitosa en papel de filtro que no desaparece a 105°C.
Reacciones
químicas características.
Saponificación.
Constantes
físicas y químicas:
Indice
de acidez:
cantidad en mg de KOH necesaria para neutralizar los ácidos libres
presentes en 1g de sustancia. Mide enranciamiento.
Indice
de saponificación:
cantidad de KOH (mg) necesaria para neutralizar los ácidos libres
y saponificar los ésteres, en 1g de sustancia (se titula con HCl)
Indice
de éster:
diferencia entre los dos índices anteriores.
Indice
de iodo:
cantidad de iodo fijada a 100g de sustancia.
Indice
de peróxidos:
es el número que expresa en mEq de O2
activo la cantidad de peróxido contenido en 1000g de sustancia.
Insaponificable:
es el % de sustancias no volátiles a 100-105°C, obtenidas por
extracción con un disolvente inorgánico, de una disolución de la
muestra previamente saponificada.
Azúcares.
Definición:
Compuestos
que contienen C, H y O, estando presente el H y el O en las mismas
proporciones que en el agua. Responden a la fórmula: Cn(H2O)n.
Químicamente
son estructuras aldehídicas o cetonas polihidroxiladas y sus
derivados.
Están
constituidos por una o más subunidades carbonadas.
Monosacáridos:
unidades simples.
Oligosacáridos:
de 2 unidades a menos de 10 unidades.
Polisacáridos:
más de 10 unidades.
Desoxiazúcares:
tienen reemplazado el -OH del C2
por un H.
Heterósidos:
resultante de la combinación de una o varias unidades de
monosacáridos con otra molécula de estructura no glucídica.
Propiedades
fisicoquímicas.
Son
sustancias sólidas, incoloras, cristalinas.
Generalmente
son dulces.
Solubles
en agua y poco solubles en alcohol absoluto. Son solubles en
metanol.
Son
ópticamente activas.
Generalmente
reductores (por su grupo aldehído)
Estables
en ácido diluido y en caliente.
Fermentan
en presencia de levaduras.
Generalmente
adoptan estructura cíclica:
Caracterización.
Todos
los azúcares con la función aldehído o cetona libre, reducen las
sales metálicas en medio alcalino.
(Estas
reacciones son para azúcares reductores, los azúcares no reductores
no dan estas reacciones).
Reacciones
que se basan en el calentamiento en medio sulfúrico, se forma el
furfural que se condensa con fenoles y aminas dando compuestos
coloreados.
(Estas
reacciones son para azúcares en general, reductores y no
reductores).
Para
desoxiazúcares (azúcares que tienen reemplazado el -OH por -H en el
C2)
Heterósidos.
Definición:
Son sustancias producidas por la condensación del grupo reductor de
un azúcar (glucón) con una molécula no glucídica (aglucón) con
pérdida de una molécula de agua (son acetales).
Clasificación:
Propiedades
fisicoquímicas.
Sólidos
cristalinos, incoloros o coloreados.
Su
solubilidad dependerá de:
la
naturaleza química del aglucón,
el
número de azúcares unidos,
el
tipo de unión O, C, S o N.
A
causa de la naturaleza hidrofílica del azúcar que tiene unido, son
solubles en agua y solventes polares; también son solubles en
metanol.
Se
hidrolizan
por calentamiento en medio ácido o básico diluido, o por medio de
enzimas.
Se
extraen, por lo general con agua en caliente, alcohol, mezclas de
alcohol/agua, metanol, acetato de etilo y acetona.
Flavonoides.
Los
flavonoides se encuentran mayormente en las flores.
Definición:
son compuestos de fórmula general C6-C3-C6.
Aglucón
De
acuerdo al grado de saturación y oxigenación de la cadena C3
y la presencia de grupo carbonilo en C4.
Propiedades
fisicoquímicas.
Sólidos
cristalinos generalmente amarillos (por los dobles enlaces
conjugados la molécula tiene dos cromóforos).
Las
antocianidinas (sin grupo cetónico) son rojas en medio ácido y
azules en medio alcalino.
Los
heterósidos flavonoides son solubles en agua caliente, alcohol,
metanol, mezclas de metanol/agua, acetato de etilo y acetona.
El
aglucón flavonoide es soluble en solventes poco polares. A mayor
cantidad de grupos -OH aumenta su solubilidad en solventes polares.
Caracterización.
- FeCl3
en metanol.
No
es una reacción específica para flavonoides, es una reacción para
-OH fenólicos.
Antraquinonas.
Definición:
son compuestos derivados de la 9,10 antraquinona. Poseen grupos -OH
en diferentes posiciones.
Tienen
acción catártica (laxantes fuertes).
Se
pueden encontrar libres (sin azúcares), como O y C heterósidos o
como ambos (cascarósidos).
Propiedades
fisicoquímicas.
Sólidos
cristalinos amarillos o anaranjados.
Presentan
fluorescencia naranja característica al UV.
Subliman.
Los
heterósidos
se extraen con agua caliente o con acetato de etilo, acetona o
metanol.
Los
aglucones
se extraen con solventes poco polares como benceno (solvente por
excelencia pero cancerígeno), hexano, CCl4,
éter de petróleo.
Tango
aglucones como heterósidos se extraen en soluciones alcalinas.
Es muy probable que tanto los aglucones como los heterósidos tengan
grupos -OH, y éstos en medio alcalino se desprotonan y salifican y
de esta manera son solubles en este medio. Si se cambia el pH,
acidificando el medio, se protonan los -OH y de esta manera los
aglucones dejan de ser solubles pero los heterósidos
antraquinónicos siguen siendo solubles en ese medio (por los grupos
azúcares).
Los
O-heterósidos se hidrolizan más fácilmente que los C-heterósidos,
éstos últimos necesitan generalmente un catalizador y condiciones
más drásticas.
Caracterización.
Cáscara
sagrada.
La
cáscara sagrada contiene alrededor de 6-9% de derivados antracénicos
presentes como O-heterósidos y C-heterósidos.
El
70-90% es una mezcla compleja de hydroxiantracenos del tipo
C(10)-Glucosilantronas.
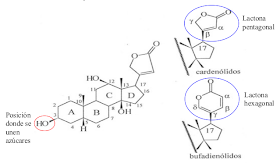
Saponinas.
Definición:
Son compuestos que producen espuma, similar a los jabones, por
agitación en agua. Tiene poder hemolítico y son tóxicas para
animales de sangre fría.
Existen
dos tipos de saponinas:
Esteroides.
Triterpénicas.
Alcaloides.
Definición:
Son
sustancias complejas que tienen acción farmacológica sobre el SNC
aún a dosis bajas.
Poseen
un N heterocíclico en su molécula.
Tienen
características básicas.
Se
originan biosintéticamente a partir de aminas biógenas.
Son
de origen vegetal.
Extracción de alcaloides en medio ácido.
Extracción de alcaloides en medio básico.
Extracción de alcaloides en medio neutro.
Caracterización.
Reacción
de Dragendorff (Bi/IK): ↓
naranja
Reacción
de Mayer (Hg/IK en medio
ácido): ↓ blanco
Reacción
de Bouchardat (I2/IK
en medio ácido) ↓ marrón
Reacción
de Hager (solución saturada
de ácido pícrico en medio ácido): ↓ amarillo
Reacción
de Ehrlich
(p-dimetilaminobenzaldehído en etanol al 5% en medio ácido →
para núcleos indólicos. ↓ naranja
Tiocianato
de cobalto (solución al 2% de
Co(CNS)2:
↓ azul.