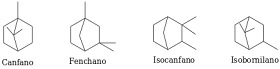
Hay tres clases principales, que dependen del tamaño de ambos anillos.
Clase I (6+3)
La numeración 6+3 indica el número de átomos de carbono del anillo fundamental (6) y los del anillo secundario (3).
Clase II (6+4)
Clase III (6+5)
De esta serie (incompleta) de estructuras veremos únicamente dos derivados del canfano (alcanfor y borneol) y dos del pinano (α y β-pinenos).
Pinano.
Es el hidrocarburo saturado del cual derivan los pinenos naturales. Puede obtenerse por reducción catalítica de α o β-pinenos.
Según la ubicación espacial del grupo metilo C1 con respecto al gem-dimetilo, son posibles dos formas: cis y trans o endo y exo.
Aunque tiene tres carbonos asimétricos, solo son posibles dos epímeros (diasteroisómeros), cada uno formando un par de enantiómeros. Esto es debido a que el puente gem-metilo sólo puede formarse mediante enlaces cis (uniones 2,8 y 4,8 cis) pues para tener unión trans (uniones 2,8 y 2,8 trans) requerirían distancias interatómicas C-C muy grandes.
Cada una de estas formas se presenta como un par de enantiómeros y un racémico.
La presencia del puente gem-metilo estabiliza la forma bote haciéndola rígida.
Los derivados no-saturados del pinano son tres: α y β (naturales) y δ (sintético).
No existe la posibilidad de algún otro pineno pues el doble enlace comprendería a un átomo de carbono cabeza de puente.
Un doble enlace en un carbono cabeza de puente en un anillo pequeño implicaría una deformación muy grande de los ángulos de valencia.
Esta imposibilidad dio lugar a la formación de la regla de Bredt: la introducción de un doble enlace en un átomo cabeza de puente de sistemas bicíclicos no es posible en condiciones normales y sólo puede formarse el doble enlace en condiciones drásticas que conducen a la ruptura de uno de los anillos.
La fusión de ambos anillos, o sea la formación del puente, solamente puede ocurrir por las posiciones cis, ya que en la trans la distancia interatómica C-C debe ser muy grande.
Esto trae como consecuencia que cada pineno se presente sólo como un par de enantiómeros (y su racémico).
y si lo representamos con el grupo gem-dimetilo arriba solo habremos dibujado la imagen especular al anterior.
Lo mismo ocurre con el β-pineno. Por la particular geometría de la molécula de β-pineno, la molécula no tendrá forma bote o silla. Los átomos de carbono A, B, C, D y E se encontrarán en un plano pues de esa manera habrá el mínimo de repulsión entre los hidrógenos del metilo H y el hidrógeno G del átomo de carbono C.
Aunque tienen dos carbonos asimétricos, por las razones antes vistas, sólo es posible, en cada caso la existencia de un par de enantiómeros. Es posible distinguir ambos compuestos por resonancia magnética nuclear: en el α-pineno puede observarse a campos bajos la señal C=C-CH3, que no se observa en el β-pineno. Además los dos grupos metilo del gem-dimetilo, en ambos casos no son equivalentes y por lo tanto se ven a campos diferentes. En cada caso, el grupo metilo más cercano al doble enlace se ve influenciado por la nube electrónica del mismo y se tiene entonces:
Por lo tanto en el β-pineno se observan sólo dos señales de grupos metilo, mientas que en el α se observan tres.
Canfano y derivados.
El alcanfor es su derivado más importante y son conocidas sus formas (+) y (-), naturales, y (±) sintética.
Hasta hace algunos años, el alcanfor era un producto importante por su uso industrial (fabricación de celuloide) y en farmacia. Como consecuencia de haber caído en desuso el celuloide (debido a su alta combustibilidad), desplazado por el acetato de celulosa (plástico semisintético), el Mylar (sintético), etc, ha perdido su importancia.
Estereoquímica del alcanfor.
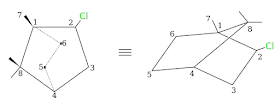
Los átomos de carbono cabeza de puente en el alcanfor son asimétricos, por lo que el alcanfor debería tener 22 isómeros ópticos.
22= enantiómeros ∴ 2 racémicos
Sin embargo, dada la imposibilidad ya vista para otros biciclos (por ejemplo, pinanos), sólo se conocen dos enantiómeros y un racémico.
Este sistema bicíclico es bastante estable, pero en determinadas reacciones puede producirse la apertura del anillo hexagonal. Un ejemplo lo tenemos en la transposición de Beckmann de la alcanfor oxima.
En condiciones normales, las oximas pueden sufrir una transposición de Beckmann para dar amidas.
Y de manera similar puede formarse
En el caso de la alcanfor oxima tendríamos:
Pero estos productos no se forman; ocurre, en cambio una deshidratación con apertura del anillo, obteniéndose un nitrilo.
Reducción del alcanfor.
Se produce la formación de dos alcoholes epímeros (diasteroisómeros) proponderando uno u otro según el agente reductor usado.
El acercamiento del reactivo sobre el grupo carbonilo se produce con mayor facilidad por el lado endo pues por el lado exo se encuentran los grupos metilo (del puente y de la cabeza de puente) que representan un impedimento estérico apreciable.
La reducción de la cetona derivada del norbornano ya sea por vía química o catalítica, produce principalmente el alcohol endo-, lo que implica que el acercamiento del reactivo tiene mayor facilidad por el lado exo-.
En el alcanfor, la presencia de los metilos 7 y 9 dificulta el ataque por el lado exo; habiendo en consecuencia, menor impedimento por el lado endo, se produce preferentemente el alcohol exo-.
En este caso la reacción es controlada por el "acercamiento" estérico y por lo tanto el ataque del reactivo (H4AlLi, Al(i-PropO)3 ó H2/cat) se producirá más fácilmente desde el lado de la molécula opuesto al puente, produciéndose preferentemente exo-borneol.
Transposiciones de Wagner-Meerwein.
Son una serie de reacciones que ocurren por reordenamientos moleculares, en las que se forman iones carbonio en una o más etapas intermedias.
1) Deshidratación del borneol en medio ácido.
2) Adición de HCl(g) al α-pineno: Formación del endocloruro de bornilo.
3) Adición de HCl(g) al canfeno: Formación de cloruro de bornilo.
4) Reacción de acetólisis de los brosilatos de norbornilo: Formación del exo-acetato de norbornilo.
En las reacciones 1, 2 y 3, podemos ver que por el mecanismo clásico se forma el ion carbonio (en los tres casos es el mismo ion carbonio):
Ahora bien, hay varios hechos que no permiten aceptar este mecanismo. Si consideramos las reacciones 2 y 3, no es posible que en ambos casos el mismo ion carbonio, reaccionando con el mismo reactivo (Cl-) dé dos compuestos diferentes. Según los mecanismos clásicos, al ser planar, es subceptible al ataque por ambos lados originando, si el ion carbonio está sobre un carbono asimétrico, un racémico. A lo sumo si hay distinta facilidad para que se produzca el ataque por ambos lados, se obtendría una mezcla de isómeros en distintas proporciones (racemización parcial).
Por ejemplo:
En los casos 2 y 3 tendríamos que tener una mezcla de exo y endo cloruro de bornilo, en la que debería predominar el endo ya que el acercamiento del Cl- sería más fácil por el lado endo por haber menos impedimento estérico.
Sin embargo, los resultados experimentales muestran para el caso 2 el predominio del endo y para el 3 el predominio del exo.
Para el caso 4, si la reacción fuese del tipo SN2, a partir del exo-brosilato se debería obtener el endo (ataque por retaguardia con inversión de la configuración) y con el endo debería formarse el exo. Si el mecanismo fuese del tipo SN1, a partir de cualquiera de los dos tendríamos que obtener una mezcla.
Otro fenómeno anómalo es que la reacción de acetólisis del brosilato exo es 36000 veces mayor que la del endo. Este hecho se explica por el "efecto anquimérico o de ayuda por grupo vecino". Para ello se toma en cuenta la ubicación relativa, con respecto a los carbonos 1 y 2 del grupo brosilato y del par de electrones de la unión sigma de los carbonos 2 y 3. En el caso del exo-brosilato este grupo y el par de electrones son transoides, en el endo son cisoide. La posibilidad del par de electrones de atacar por retaguardia al grupo brosilato (reacción del tipo SN2) ocurre únicamente para el exo-brosilato.
Esto no explica la formación exclusiva del exo-acetato. Hay varias teorías que trataron de explicar estos resultados experimentales, casi todas ellas tienden a coincidir a que la causa de los mismos es que el ion carbonio formado no es único, sino que la carga positiva se encuentra deslocalizada en por lo menos tres átomos de carbono vecinos.
Este tipo de deslocalización da lugar a la formación del "ion carbonio no clásico", que para el nor-bornilo puede representarse así:
La formación de este ion carbonio no clásico puede perfectamente explicar la estereoespecificidad de las reacciones vistas.
Vamos a comenzar por el caso más sencillo. Vamos a considerar el catión nor-bornilo:
Si lo representamos en forma plana al anillo pentagonal formado por los carbonos 1, 2, 3, 4 y 7, tendremos que los carbonos 5 y 6 deberían representarse por encima o por debajo del plano, supongamos que están por debajo, las formas resonantes extremas serían entonces las siguientes:
o sea que el carbono 5 estaría unido alternativamente a los carbonos 3 y 4 (mecánicamente sería como un limpiaparabrisas que teniendo un punto de apoyo en el carbono 5 se mueve entre los carbonos 3 y 4). Esta circunstancia dificulta el acercamiento del nucleófilo por el lado del carbono 5 (en nuestro caso en particular por debajo), por lo tanto el nucleófilo solo podrá atacar por el lado opuesto al carbono 5 (en nuestro caso particular, por arriba).
Un caso semejante es el de la formación del exo-cloruro de bornilo, para el cual el ion carbonio no clásico sería el siguiente:
El ataque del Cl- debe efectuarse por el lado opuesto al carbono 6. Si el Cl- ataca al carbono 1 se vuelve al producto de partida, en cambio si ataca al carbono 2 se obtendrá:
Acá nuevamente el carbono 6 y el halógeno son transoides. Lo inexplicable mediante el mecanismo clásico, o sea la obtención del producto debido al ataque del nucleófilo por el lado más impedido estéricamente y ausencia del isómero endo, puede explicarse perfectamente por el "ion carbonio no clásico".
Otro ion carbonio no clásico permite explicar la formación del cloruro de endo-bornilo.
En este caso el efecto "limpiaparabrisas" es producido por el carbono 8. El Cl- se ve forzado a atacar por el lado endo de la molécula. Si ataca el carbono 1 se vuelve al producto de partida, pero si ataca el carbono 2 se obtiene el endo-cloruro de bornilo.
Descarga: Apunte Terpenos y Esteroides






























No hay comentarios:
Publicar un comentario