Clasificación.
Son productos naturales presentes en flores, raíces, hojas y cortezas de plantas.
A los efectos de su clasificación se tiene en cuenta el número de restos isopreno presentes en sus moléculas y así se tienen en monoterpenoides (2 x C5H8), diterpenoides (4 x C5H8), etc.
Clases
|
Fuentes naturales
|
|
Monoterpenoides
|
C10H16
|
Aceites esenciales
|
Sesquiterpenoides
|
C15H24
|
Ídem, principios amargos
|
Diterpenoides
|
C20H32
|
Resinas, principios
amargos
|
Triterpenoides
|
C30H48
|
Insaponificables de
plantas, saponinas, etc
|
Tetraterpenoides
|
C40H64
|
Carotenoides
|
Politerpenoides
|
(C10H16).n
|
Caucho
|
A su vez se pueden subdividir en: acíclicos, monocíclicos, bicíclicos, tricíclicos y policíclicos.
Regla del isopreno.
La posibilidad de poder considerar a los terpenoides como formados por la unión de restos de isopreno, condujo a la formulación de esta regla.
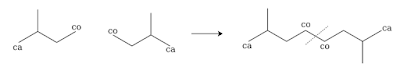
La misma dice que los terpenoides pueden ser divididos arbitrariamente en unidades isopreno, y que dichas unidades están unidas cabeza-cola.
Esta regla del isopreno tiene varias excepciones:
a) En los carotenoides, la unión en la parte central es cola-cola.
Como podemos ver, en este caso la orientación de los sustituyentes es opuesta en cada una de las mitades.
b) Algunos monoterpenoides tienen un número de átomos de carbono que no es múltiple de 5, por ejemplo en la cryptona.
La cryptona puede obtenerse en el laboratorio por oxidación del β-felandreno. Es significativo que ambos compuestos se encuentren en el aceite esencial de eucaliptus, por lo que muchos consideran que la cryptona puede ser un "artefacto" o sea producida por oxidación durante su extracción.
c) Existen algunos terpenoides que, a pesar de tener un número de átomos de carbono múltiplo de 5, no pueden dividirse correctamente en grupos isopreno. Un ejemplo de esto lo tenemos en la eremofilona, isómera de la carissona. Esto es debido a que durante su biogénesis ocurren una o más transposiciones.
Importancia de los terpenoides.
Son compuestos importantes tanto desde el punto de vista biológico como desde el industrial. Biológicamente son "precursores" de los esteroides, que son moléculas fundamentales ya que su esqueleto se encuentra en vitaminas (vitamina D) y hormonas importantísimas (sexuales y corticoides).
Industrialmente son pocos los terpenos que se utilizan al estado puro (mentol y alcanfor principalmente), pero las mezclas de terpenos halladas en los aceites esenciales o las mezclas de aceites esenciales son utilizados en gran cantidad en perfumería y cosmética.
Extracción y purificación.
Los métodos de extracción de los terpenoides dependen de su peso molecular. En general los monoterpenos, los sesqui- y los diterpenos pueden separarse de la parte no esteroide por destilación por arrastre con vapor de agua. En cambio los terpenoides superiores se extraen con solventes orgánicos junto con las grasas y aceites (esenciales o no).
En Argentina se producen comercialmente mentol y algunos tipos de aceites esenciales. Los de mandarina, naranja y limón se obtienen prensando la cáscara de los frutos y el jugo obtenido se emulsiona y luego se separa el aceite de la emulsión por centrifugación.
Otro método usado es: el "enfleurage". Este método es empleado en perfumería para preparar extractos finos y consiste en macerar los pétalos de flores con grasas purificadas, luego se filtra en caliente para separar los sólidos y de la "pomada" resultante se destila el aceite esencial por arrastre por vapor.
Para separar los distintos componentes de sus mezclas se usa generalmente la destilación fraccionada a presión reducida y con columnas rectificadoras de alta eficacia. También se utiliza la formación de derivados cristalinos y cristalización fraccionada. En los últimos años se emplea preferentemente la cromatografía, ya sea en columna, placa, gaseosa o líquido-líquido.
Estudio de sus estructuras.
Actualemente se utilizan métodos químicos combinados con métodos físicos.
Los métodos químicos más usados son los de tipo degradativo, principalmente las reacciones de oxidación en distintas condiciones y con diferentes agentes oxidantes: IO- u O3 (moderadamente específicos); KMnO4 en medio neutro o alcalino (no muy fácil de controlar); CrO3/HAc; CrO3/H2SO4 (poco selectivo); OsO4 y HIO3 (muy caros).
Un tipo de reacciones que tuvieron importancia son las de aromatización por calentamiento con S, Se, Pd o Pt, pero este método produce mezclas y ya no se usa.
Más utilizadas son las reacciones de adición a dobles enlaces, tales como la adición de bromo, hidrógeno y de cloruro de nitrosilo. Las dos primeras pueden hacerse cuantitativamente y determinar así la cantidad de dobles enlaces presentes.
Finalmente, se utilizan las reacciones de caracterización de grupos funcionales y en pocos casos la de formación de derivados que permitan identificar un producto.
Lógicamente todos estos métodos deben efectuarse sobre los compuestos puros, separados de sus mezclas.
En la actualidad, todos estos métodos se ven reforzados y en algunos casos suplantados por los métodos físicos.
Espectrofotometría UV
Permite determinar la presencia de sistemas conjugados (dienos, trienos y compuestos carbonílicos α,β-no saturados).
Utilizando las reglas de Woodbard y Fieser se puede predecir y confirmar estructuras probables.
Espectroscopia de IR
Permite determinar la presencia o ausencia de grupos funcionales en la molécula.
Espectroscopia de RMN
Permite predecir estructuras hidrocarbonadas y determinar la presencia o ausencia de grupos funcionales que contengan H activo (alcoholes, fenoles, enoles, ácidos carboxílicos, distinguir entre aldehídos y cetonas, etc)
En los últimos años, el uso de la RMN de carbono 13 permitió obtener detalles muy útiles sobre el esqueleto de átomos de carbono y predecir la configuración de los centros de asimetría óptica.
Espectrofotometría de masa
Permite determinar el peso molecular exacto y además, mediante el estudio de fragmentación del ion molecular, obtener datos útiles, de estructuras complejas.
Otros métodos utilizados son ópticos, tales como el poder rotatorio, y más útiles aún tenemos la Dispersión Óptica Rotatoria y el Dicroismo Circular, que permiten determinar conformaciones de anillos y configuraciones de centros asimétricos.
Un problema que se presenta a menudo es la posibilidad de que durante los procesos de separación o purificación o por acción de determinados reactivos se produzcan transposiciones moleculares que pueden conducir a errores en la determinación de estructuras.




No hay comentarios:
Publicar un comentario